
라이뷰
마스터링 AI
인공지능, 물리학으로 돌파구 열고 화학 난제 길 열다
2024/10/22
에디터 노트
2024년 노벨상은 여러 모로 화제였습니다. 소설가 한강이 수상한 문학상이 국내에선 가장 큰 이목을 끌었지만, 세계적으로는 물리와 화학상을 휩쓴 인공지능(AI)이 많은 화제를 낳았죠. 물리학상의 경우 인공신경망과 딥러닝의 원리를 물리학 분야에서 찾은 컴퓨터과학자가, 화학상도 단백질 해석 인공지능을 개발한 전문가가 수상자에 포함되면서 이 또한 화제가 됐습니다. 그런데 정작, 이들이 수상한 업적을 물리학, 화학적으로 자세히 알기는 어렵습니다. 그래서 최고 전문가들의 해설을 준비했습니다. AI 및 AI 반도체 전문가 최기영 전 서울대 교수(전 과학기술정보통신부 장관)와 AI 및 생명정보학 정문가 백은옥 한양대 교수가 과학적, 기술적 의미를 자세히 설명합니다.
올해 노벨 물리학상과 화학상은 인공지능(AI) 구현과 AI를 이용한 단백질 연구 분야에 각각 돌아갔다. 물리학상은 인공신경망을 이용한 기계학습의 기반이 되는 발견과 발명을 한 공로로 존 홉필드 미국 프린스턴대 교수와 제프리 힌튼 캐나다 토론토대 교수가 받았다. 화학상은 컴퓨터와 AI를 이용한 단백질 설계 방법을 개발한 데이비드 베이커 미국 워싱턴대 교수와, AI를 이용한 단백질 구조 예측 방법을 개발한 구글 딥마인드의 데미스 허사비스 대표와 존 점퍼 수석연구원 3인이 공동 수상했다.
AI는 최근 10여 년간 영상 인식 대회와 바둑 대결, 챗봇 서비스 등에서 뛰어난 성취를 보여주며 이미 여러 차례 우리를 놀라게 했다. 여기에 노벨상까지 두 분야에 수여되면서 세상에 다시 한번 충격을 줬다. 수상자들이 어떤 업적으로 선정됐는지, 그것이 인공지능과 어떻게 연결되며 어떤 의미를 갖는지 과학과 기술의 관점에서 살펴보자.
신경의 학습을 물리학으로 해석하다
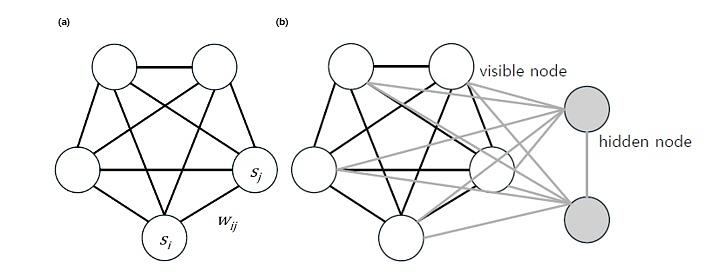
물리학상을 수상한 두 학자의 업적을 먼저 살펴보자. 존 홉필드는 1982년, 그림 1(a)와 같이 N개의 노드(결절점)와 그 사이의 연결로 이뤄진 네트워크 모델(홉필드 네트워크)을 바탕으로 한 인공신경망을 발표했다. 이 모델에서 각 노드는 0 또는 1의 이진 값 si를 가지며, 노드와 노드 사이의 연결선은 가중치 wij(wii = 0)를 갖는다. 여기에서 노드는 사람 두뇌의 신경세포에 해당하고, 값이 1이면 신경세포가 출력을 내보낸다는 것을 뜻한다. 연결선은 시냅스에 해당하고 가중치의 값은 시냅스 연결의 강도를 뜻한다.
이 네트워크를 학습시키는 방법은 학습에 사용하는 일련의 N-bit 입력 벡터를 노드에 가하면서 연결선의 가중치를 그 연결선 양쪽에 있는 노드 값의 상관관계로 갱신하는 것이다. 그러면 학습에 사용한 벡터들이 네트워크에 저장된다. 네트워크의 에너지를 다음과 같이 정의하면,
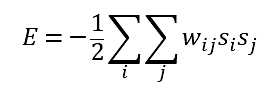
학습이 끝난 후 가중치는 고정시키고, 새로운 입력 벡터를 가한 후 각 노드의 값을 다음 수식(이 수식은 신경세포의 동작에 대한 간단한 모델로 널리 사용된다)에 따라 업데이트 하면,
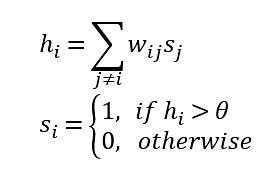
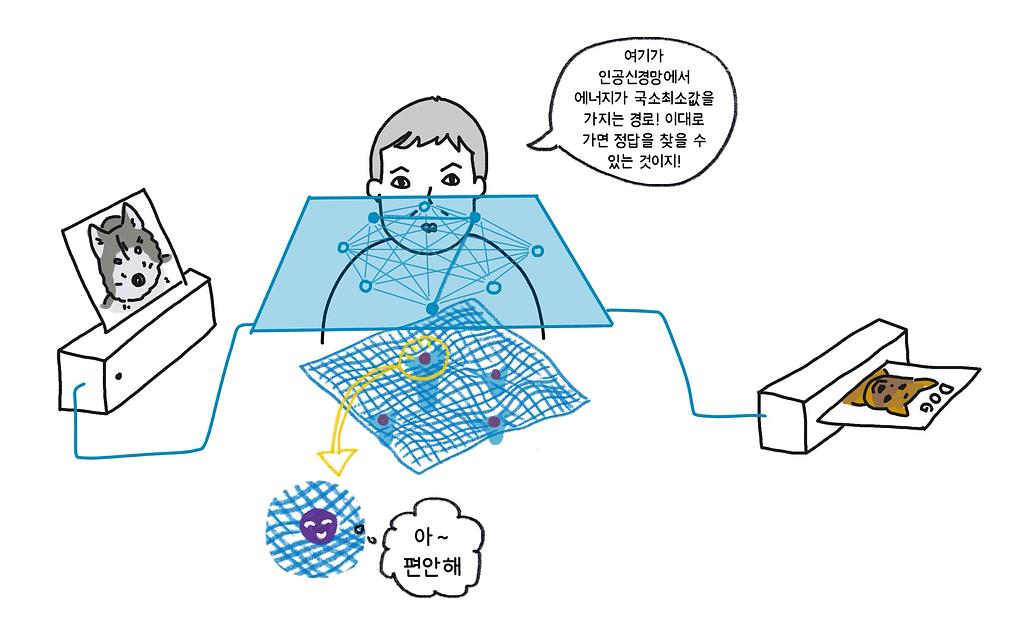
최종 노드의 값은 네트워크에 저장한 벡터 중 새로운 입력 벡터와 가장 가까운 벡터의 값(즉 에너지의 국소최솟값)이 된다. 즉 어떤 데이터를 입력으로 주면 저장된 데이터 중 그 입력과 가장 가까운 것을 찾아주는 연상기억장치(associative memory)로 동작한다. 예를 들면, 개와 고양이 사진을 저장한 네트워크에 새로운 사진을 보여주면 그것이 개에 가까운지 고양이와 가까운지 찾아주는 식이다(사실 이는 그저 개념적으로 설명한 것이고, 이 네트워크만으로 개와 고양이를 구분하는 것은 어려울 것이다).
인공신경망에 저장된 정보를 찾는 문제를 에너지가 최소가 되는 지점을 찾아가는 물리적 현상으로 해석함으로써 해법의 이론적 기반을 마련한 것은 존 홉필드가 물리학자였기 때문에 가능했을 것이라고 생각한다 (그림 2).
심층신경망 길 연 힌튼
공동 수상자인 제프리 힌튼 교수는 AI와 관련해 많은 업적을 쌓았다. 그 가운데에는 1983~1985년 발표한 볼츠만 기계(Boltzmann machine)가 있다. 홉필드의 네트워크 모델을 확장한 것으로, 홉필드 네트워크와 다른 점은 네트워크 상태에 대한 확률분포를 고려한다는 점이다. 에너지가 감소하는 방향으로만 노드 값을 변경하는 홉필드 네트워크와 달리, 에너지가 증가하는 방향으로도 네트워크 상태가 움직일 수 있게 함으로써 원하지 않는 국소최솟값에 빠지는 문제를 개선할 수 있다. 물론 에너지가 증가하는 방향으로 움직이는 확률은 크지 않도록 조절한다. 네트워크 상태는 볼츠만 분포(다수의 입자로 구성된 계가 열평형 상태를 이뤘을 때 입자의 에너지 분포)를 따르도록 하는데 그것이 네트워크를 볼츠만 기계라고 부르는 이유다.
볼츠만 기계가 홉필드 네트워크와 다른 점은 또 있다. 그림 1(b)와 같이 외부에서 접근 가능한 노드의 집합인 가시노드(visible node) 외에, 감춰져 있는 은닉노드(hidden node)를 추가적으로 두고 있다는 점이다. 가시 노드는 입력 데이터 값이나 원하는 출력 데이터 값을 갖는 노드이고, 은닉노드는 값이 자유롭게 변할 수 있는 노드다. 은닉노드를 둠으로써 네트워크는 전체적으로 볼츠만 분포를 잘 유지할 수 있게 된다.
힌튼의 또 다른 주요 업적은 1986년에 발표된 역전파(backpropagation)를 이용한 학습이다. 이는 홉필드 네트워크나 볼츠만 머신과 같은 순환 신경망(recurrent neural network)이 아니라, 그림 3처럼 입력층(input layer)부터 은닉층(hidden layer)을 거쳐 출력층(output layer)까지 순방향의 연결만 있는 순방향 신경망(feedforward neural network)을 대상으로 한다.
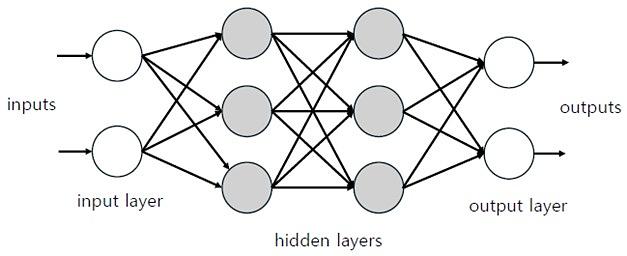
학습 방법은 먼저 학습용 입력 데이터를 가해서 출력값을 구하고, 그 값이 원하는 출력값과 차이가 있을 때 그 오차를 출력에서 입력 쪽으로 역전파시키면서 출력에서의 오차를 줄이는 방향으로 각 노드의 가중치를 조정하는 것이다. 최적의 가중치를 찾아가는 과정에 기울기하강(gradient descent, 경사하강이라고도 한다. 최솟값을 발견하기 위한 최적화 알고리즘으로, 함수의 기울기를 구한 뒤 내려가는 방향으로 이동시키는 과정을 반복해 극값을 구한다) 방법을 적용하고 있는데, 방법은 다르지만 최적해를 향해서 학습을 반복하는 원리는 앞선 연구를 바탕으로 한 것이다.
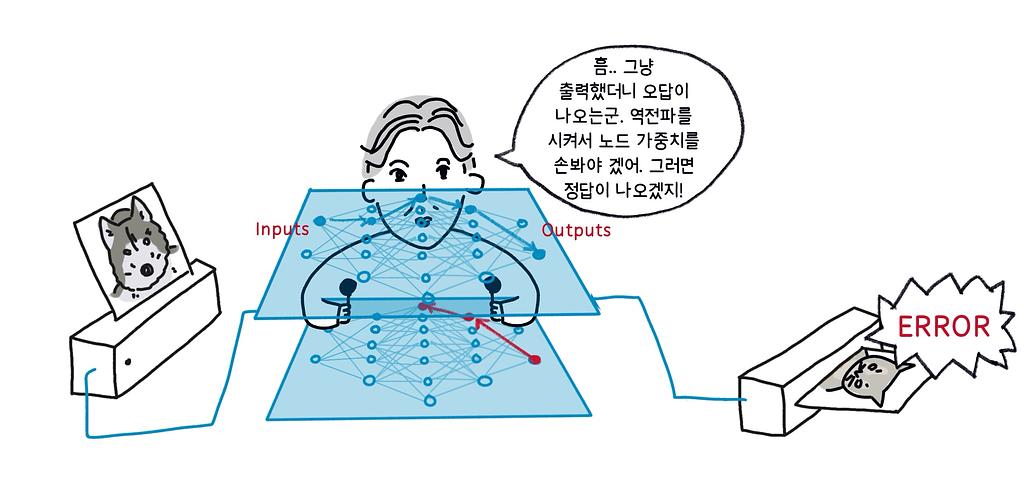
홉필드와 힌튼의 이런 연구 성과는 ‘인공지능 겨울’이라고 불리던 소강 상태를 견디며 연구에 몰두한 연구자들의 노력 덕분에 심층신경망(deep neural network)에 대한 후속 연구로 이어졌고, 지금의 AI 붐을 일으키는 기반이 됐다.
단백질 구조에 주목한 화학자·컴퓨터과학자
2024년 노벨 화학상의 절반은 AI를 활용해서 단백질의 3차원 구조를 예측하는 소프트웨어인 알파폴드2를 개발한 구글 딥마인드의 데미스 허사비스와 존 점퍼가 공동으로 수상했다. 나머지 절반은 자연계에 존재하지 않는 새로운 단백질을 디자인하는 계산적인 방법(소프트웨어)을 개발한 데이비드 베이커 워싱턴대 교수에게 돌아갔다.
양쪽이 약간은 다른 공적을 인정받았지만 공통점이 있다. 단백질의 구조와 관련된 연구를 했고, 주된 연구 방법으로 소프트웨어를 개발해 이용했다는 점이다.
우선 단백질 구조가 왜 노벨상을 받을 만큼 중요한지 살펴보자. 단백질은 생명 현상을 이루는 모든 과정에 등장하는 가장 핵심적인 분자다. 세포 안에는 물, 지질, 당, 단백질 등 다양한 종류의 물질이 존재한다. 이 가운데 DNA에 적혀 있는 유전정보로부터 만들어지는 물질이 단백질이다. 세포의 성장, 분열, 노화, 사멸하는 모든 과정에서 필요한 단백질이 DNA에 저장된 유전정보를 기초로 만들어진다. 상당수의 단백질은 생체 내에서 수행하는 다양한 기능이 이미 잘 밝혀져 있다. 우리가 마신 우유를 소화시키는 효소도 단백질이고, 신종 코로나바이러스 감염증을 일으키는 코로나19 바이러스로부터 우리를 보호하는 항체도 단백질이다. 혈액 내에서 산소를 운반하는 헤모글로빈도 단백질이다.
이렇게 단백질이 어떤 기능을 수행할 수 있는 것은 특정한 구조를 갖기 때문이다. 예를 들어, 항체는 대상이 되는 항원과 레고 블록처럼 딱 들어맞는 구조를 가지기 때문에 항원을 무력화하는 면역반응을 일으킬 수 있다.
단백질의 구조를 알게 되면 이처럼 생명 현상을 잘 설명할 수 있을 뿐만 아니라, 질병을 진단하거나 사전에 예방하고 치료제를 개발하는 데에도 활용할 수 있다. 예를 들어, 코로나바이러스의 스파이크 단백질의 구조를 이용해서 바이러스 항원을 검출하는 물질을 설계할 수도 있고, 스파이크 단백질이 세포에 침투하기 위해 결합하는 안지오텐신전환효소2(ACE2) 수용체 단백질의 구조를 이용하면 둘 사이의 결합을 방해하는 물질을 설계할 수도 있다.
단백질은 20종류의 아미노산이 한 줄로 연결된 서열 형태를 가진 폴리머이다. 짧게는 수십 개, 길게는 수천 개의 아미노산이 하나의 단백질 분자를 이루는데, 20종류의 아미노산이 어떤 순서로 연결돼 서열을 구성하느냐에 따라 서로 다른 단백질이 된다. DNA에 저장돼 있는 유전 정보로부터 만들어진 아미노산 서열은 스스로 ‘접힘'이라는 과정을 통해 3차원 구조를 갖게 되는데, 이 때 에너지 측면에서 가장 안정된 구조를 찾아간다.
그 동안에는 단백질의 구조를 밝히기 위해 주로 실험을 활용했다. 대표적으로 X-선 결정학, 핵자기공명(NMR), 극저온 전자현미경(CryoEM)을 활용하여 단백질 구조를 규명하였고, 이 가운데 X-선 결정학과 극저온 전자현미경은 단백질 구조 규명에 활용될 수 있음을 밝혀 각각 1962년과 2017년에 노벨 화학상을 받았다. 그러나 실험적으로 단백질 구조를 밝히는 것은 시간과 비용이 매우 많이 드는 일이다. 중요한 단백질 하나의 구조를 밝히는 연구는 박사학위를 받을 만큼의 연구성과로 인정됐을 정도다.
하나의 아미노산 서열로부터 고유한 단백질 구조가 결정된다는 사실을 밝혀 미국국립보건원(NIH)의 크리스천 앤핀션이 1972년 노벨 화학상을 받았다. 그 후 지난 50년간 많은 연구자들이 서열로부터 계산을 통해 단백질 구조를 밝히려는 노력을 기울여 왔다.
진화 정보·단백질 구조 학습해 50년 난제 푼 알파폴드2
다양한 측면에서의 발전이 이뤄졌지만, 가장 중요한 발전은 진화 정보를 활용한 데에서 왔다. 진화 과정에서 단백질에 변이가 생겼을 때 그 변이에 의해 구조가 크게 변하여 원래의 기능을 제대로 수행하지 못하게 된다고 해보자. 그 개체는 도태될 것이다. 그러나 변이가 일어나도 구조에 별로 변화가 없다면 기능이 유지돼 생존할 것이다. 이런 현상을 매우 긴 시간에 걸쳐 바라보자. 진화 과정에서 같은 조상으로부터 다른 종으로 분화한 경우에 거의 동일한 기능을 하는 유사한 단백질들이 있다. 서열은 조금씩 다르지만 기능적으로 거의 유사한 단백질을 모아 보면 기능에 핵심적인 역할을 하는 서열 패턴이 무엇인지를 알 수 있다.
알파폴드2는 지난 50년간 밝혀진 수많은 단백질 데이터와 지식 그리고 알고리즘을 적절한 시점에 집대성한 결과다. 우선 유사한 단백질 사이의 진화 정보인 MSA (다중서열정렬(Multiple Sequence Alignment) 알고리즘을 통해 얻어지기 때문에 MSA라 부른다)를 모으기 위해서는 다양한 종별로 서열 정보가 있어야 한다. 1990년대에 인간 유전체 프로젝트로 시작된 차세대유전체해독(NGS, Next-Generation Sequencing) 기술의 발달로 서열 정보가 기하급수적으로 증가했다. 실제로 알파폴드2가 사용한 MSA는 24억 개에 달하는 유전자 또는 단백질 서열로부터 생성됐다.
학습을 위해서는 MSA 외에 알려진 단백질 구조가 필요하다. 지난 50년간 수많은 연구자들이 실험을 통해 그야말로 한 땀 한 땀 쌓아 올린 단백질 구조 데이터 17만 개가 단백질 정보 은행(PDB, Protein Data Bank) 데이터베이스에 모여 있었다 (그림 5).
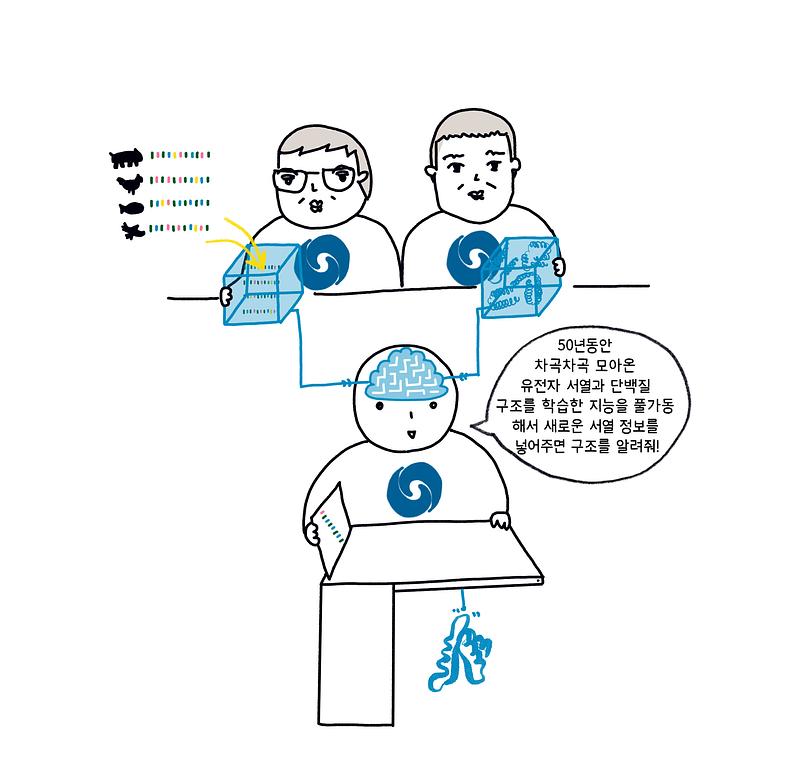
여기에 알파폴드2 학습 모델의 구조를 서열 기반의 구조 예측 문제에 아주 잘 맞게 설계했다. 최근 챗GPT(ChatGPT)로 잘 알려진 어텐션* 기반의 트랜스포머 모델**을 사용해 MSA를 구성하는 단백질의 아미노산이 가지는 공진화 패턴을 잘 학습할 수 있게 했고(Evoformer 모듈), 이 패턴을 실제 3차원 구조로 대응시키는 구조 모듈을 Evoformer와 연결해서 동시에 학습을 진행하는 종단간학습(end-to-end) 방식***의 학습이 주효했다 (BOX 1). 딥마인드에 따르면, 알파폴드2를 학습시키기 위해 수백 개의 GPU를 3~4주 동안 사용했다고 한다. 컴퓨팅 하드웨어의 발전도 알파폴드2의 성공에 크게 기여했다고 할 수 있다.
이어서 올해 딥마인드는 아이소모픽 랩스와 공동으로 알파폴드3를 발표해서 또 한 번 세계를 놀라게 했다. 알파폴드3는 단백질 분자 하나의 구조를 예측하는 것이 아니라 단백질이 다른 단백질, 혹은 화합물이나 핵산 등 다른 물질과 상호작용을 할 때의 구조를 예측하는 AI다. 상호작용 구조 예측은 신약 개발 과정에서 후보물질을 빠르게 스크리닝하거나 표적 단백질에 잘 결합하는 신물질을 개발하는 과정을 단축시킬 수 있어서 경제적 가치가 매우 크다. 딥마인드는 아직 알파폴드3 코드를 공개하지 않고 있어서 학계의 비판이 크고, 추론 코드의 활용도 매우 제한적으로 허용하고 있는 상황이다.
자연에 없던 단백질을 거꾸로 설계하다
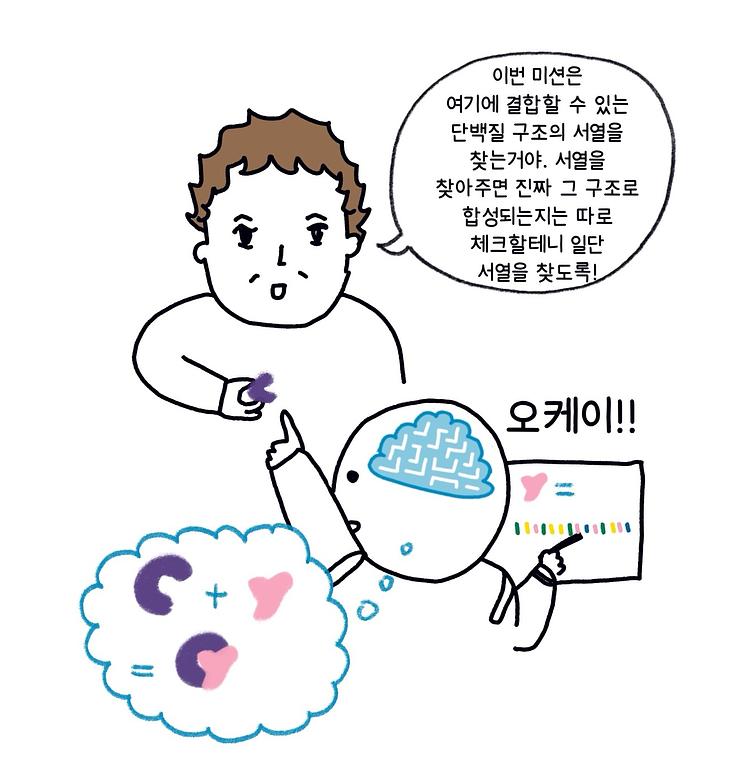
베이커 교수는 자연에는 없는 새로운 단백질을 디자인한 연구 성과를 인정받았다. 이 문제는 서열에서 구조를 예측하는 알파폴드2와 반대 방향의 문제를 푸는 것에 해당한다. 즉, 특정한 구조를 가지는 아미노산 서열이 무엇인지를 찾는 문제를 해결하고자 하는 것이다. 서열이 구조를 결정하고 구조가 기능을 결정하므로, 특정한 기능을 할 수 있는 구조를 갖는 서열을 새로 만들어 낼 수 있다면 그 용도는 무궁무진할 것이다. 다만 구조 예측과 달리, 디자인된 단백질 서열을 실제로 합성해서 접힘에 의해 원하는 구조가 만들어지는지를 확인하는 실험이 필수적으로 뒤따라야 한다.
올해 베이커 교수가 노벨상을 받은 단백질 디자인 연구는 컴퓨터를 이용한 계산을 기반으로 하고 있기는 하지만 AI를 활용한 연구는 아니었다. 그러나 베이커 그룹에서도 최근에는 단백질 디자인 연구의 주된 방법론으로 AI를 적극적으로 활용하고 있다. DALL-E처럼 문장을 입력하면 그림을 그려주는 AI에서 주로 사용돼 온 확산 모델 등 생성형 AI 기술을 이용해서 원하는 구조를 가질 수 있는 다양한 서열을 생성하기도 하고, 원하는 구조로 접히는 최적의 서열을 찾기 위해 강화학습 방법을 적극 활용하기도 한다 (그림 6).
올해 베이커 교수가 노벨상을 받은 단백질 디자인 연구는 컴퓨터를 이용한 계산을 기반으로 하고 있기는 하지만 AI를 활용한 연구는 아니었다. 그러나 베이커 그룹에서도 최근에는 단백질 디자인 연구의 주된 방법론으로 AI를 적극적으로 활용하고 있다. DALL-E처럼 문장을 입력하면 그림을 그려주는 AI에서 주로 사용돼 온 확산 모델 등 생성형 AI 기술을 이용해서 원하는 구조를 가질 수 있는 다양한 서열을 생성하기도 하고, 원하는 구조로 접히는 최적의 서열을 찾기 위해 강화학습 방법을 적극 활용하기도 한다 (그림 6).
나가며
올해 노벨 물리학상과 화학상은 일부 수상자가 전통적인 물리학자나 화학자가 아닌 컴퓨터 과학자여서 이례적이라는 말이 있다. 그래도 화학상은 단백질의 구조 예측이나 단백질 설계에 큰 도움을 주는 방향으로 AI를 활용하는 연구에 주어졌기에, 관련 화학 분야를 획기적으로 진전시켰다는 점에서 쉽게 수긍이 가고, 학자들 사이에서도 일찌감치 수상을 점친 사람도 많았다. 그러나 물리학상 수상자의 업적은 물리 법칙을 새로 발견하거나 실험적으로 증명한 사람에게 주어지던 전통적인 경우와는 달랐기에, 다소 뜻밖이라는 반응이 많았다.
하지만 사람 두뇌를 구성하는 신경망의 생물학적 구조를 추상화한 네트워크 모델을 만들고, 두뇌에서 물리, 화학, 생물학적으로 일어나는 학습 과정을 그 네트워크 모델에서 구현하기 위해서 물리 법칙에 따라 학습시키는 새로운 개념을 제시했으며, 그것을 기반으로 AI가 눈부시게 발전할 수 있었다는 점에서 충분히 수상자로 선정될 수 있었다고 생각한다. 또한 오늘날 AI는 물리학을 포함해 많은 과학, 공학 분야의 발전에 크게 기여하고 있다. 연구뿐만 아니라 일상의 거의 모든 분야에 활용되면서 인류의 삶을 혁명적으로 변화시킬 잠재력을 가졌다는 점도 수상자 결정에 영향을 줬을 것이다.
학문 분야의 발전에 크게 기여하고 인류의 미래에 많은 가능성을 열어준 노벨 물리학상과 화학상 수상자에게 찬사를 보내며, 관련 분야에서 함께 땀을 흘려가며 연구 개발에 정진한 학자와 연구자, 학생 모두의 노고에도 감사의 마음을 보낸다.
글 백은옥 한양대 컴퓨터소프트웨어학부 교수, 최기영 전 서울대 전기정보공학부 교수
그림 이솔 과학일러스트레이터·약사
기획 사단법인 집현네트워크
시리즈 기획 최기영
편집 윤신영 alookso 에디터
시리즈 기획 최기영
편집 윤신영 alookso 에디터
| 이 프로그램은 과학기술진흥기금 및 복권기금의 재원으로 운영되고 과학기술정보통신부와 한국과학창의재단의 지원을 받아 수행된 성과물로 우리나라의 과학기술 발전과 저소득 소외계층의 복지 증진에도 기여하고 있습니다.
더 나은 지식기반 사회를 향한 과학자·전문가 단체입니다.
상호 교류를 통해 지식을 집산·축적하는 집단지혜를 추구합니다.
alookso와 네이버를 통해 매주 신종 감염병, 기후위기, 탄소중립, 마이크로비옴을 상세 해설하는 연재를 진행하고 있습니다.














.jpg)

